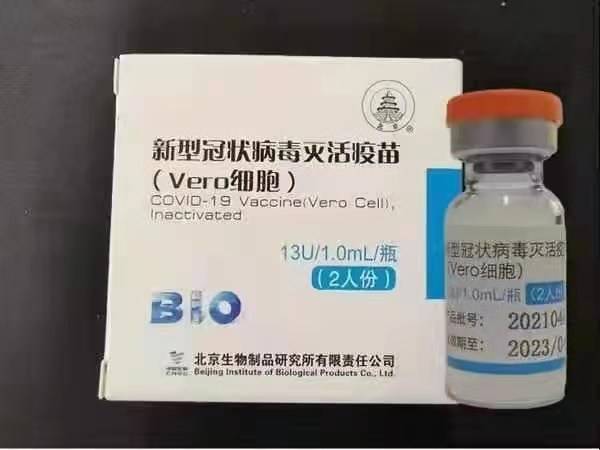
Sinopharm (Beijing): BBIBP-CorV
FASE 1
1 prøve
ChiCTR2000032459
Kina
FASE 2
2 forsøg
NCT04962906
Argentina
ChiCTR2000032459
Kina
FASE 3
6 forsøg
NCT04984408
ChiCTR2000034780
Forenede Arabiske Emirater
NCT04612972
Peru
NCT04510207
Bahrain, Egypten, Jordan, De Forenede Arabiske Emirater
NCT04560881, BIBP2020003AR
Argentina
NCT04917523
Forenede Arabiske Emirater
Godkendelser
WHOs liste over nødsituationer 59 lande
Angola 、 Argentina 、 Bahrain 、 Bangladesh 、 Hviderusland 、 Belize 、 Bolivia (plurinational stat) 、 Brasilien 、 Brunei Darussalam 、 Cambodja 、 Cameroun 、 Tchad 、 Kina 、 Comorerne 、 Egypten 、 Ækvatorialguinea 、 Gabon 、 Gambia 、 Georgien 、 Guyana 、 Ungarn 、 、 Iran (Islamisk Republik) 、 Irak 、 Jordan 、 Kirgisistan 、 Laos Folkedemokratiske Republik
Libanon 、 Malaysia 、 Maldiverne 、 Mauretanien ur auritius 、 Mongoliet 、 Montenegro 、 Marokko 、 Mozambique 、 Namibia 、 Nepal 、 Niger 、 Nordmakedonien 、 Pakistan 、 Paraguay 、 Peru 、 Filippinerne 、 Republikken Congo 、 enegal 、 Serbien 、 Seychellerne 、 Sierra Øer 、 Somalia 、 Sri Lanka 、 Thailand 、 Trinidad og Tobago 、 Tunesien 、 Forenede Arabiske Emirater 、 Venezuela (Bolivariske Republik) 、 Vietnam 、 Zimbabwe
Sinopharm BBIBP-CorV COVID-19 er en inaktiveret vaccine fremstillet af dyrkede viruspartikler, der mangler patogen evne. Denne vaccinkandidat blev udviklet af Sinopharm Holdings og Beijing Institute of Biological Products.
Sinopharm BBIBP-CorV-vaccinen virker ved at lade immunsystemet producere antistoffer mod SARS-CoV-2 beta-coronavirus. Inaktiverede virusvacciner er blevet brugt i årtier, såsom rabiesvaccine og hepatitis A -vaccine. Denne udviklingsteknologi er med succes blevet anvendt på mange velkendte vacciner, såsom rabiesvaccinen.
Sinopharms SARS-CoV-2-stamme (WIV04-stamme og biblioteksnummer MN996528) blev isoleret fra en patient på Jinyintan Hospital i Wuhan, Kina. Viruset blev formeret i kultur i en kompetent Vero-cellelinje, og supernatanten af inficerede celler blev inaktiveret med β-propiolacton (1: 4000 vol/vol, 2 til 8 ° C) i 48 timer. Efter afklaring af celleaffald og ultrafiltrering blev en anden β-propiolacton-inaktivering udført under de samme betingelser som den første inaktivering. Ifølge WHO blev vaccinen adsorberet på 0,5 mg alun og fyldt i fyldte sprøjter i 0,5 ml sterilt phosphatpufret saltvand uden konserveringsmidler.
Den 31. december 2020 meddelte State Drug Administration godkendelsen af den eksperimentelle vaccine udviklet af Sinopharm.
Den 7. maj 2021 meddelte Verdenssundhedsorganisationen godkendelsen af vaccinen. WHO's liste over nødforbrug satte lande i stand til at fremskynde deres egne lovgivningsmæssige godkendelser til import og administration af COVID-19-vaccine. WHO's rådgivende ekspertgruppe om immuniseringsstrategier har også afsluttet sin gennemgang af vaccinen. Baseret på alle tilgængelige beviser anbefaler WHO to vaccinedoser med tre til fire ugers mellemrum til voksne 18 år og ældre. Vaccineeffektivitet mod symptomatisk og hospitalsindlagt sygdom anslås til 79% for alle aldersgrupper tilsammen.
American Medical Association offentliggjorde "A Randomized Clinical Trial: Effect of 2 Inactivated SARS-CoV-2 Vaccines on Symptomatic COVID-19 Infection in Adults" den 26. maj 2021 og konkluderede, at "i denne forudspecificerede midlertidige analyse af et randomiseret klinisk forsøg, voksne De 2 inaktiverede SARS-CoV-2-vacciner administreret i denne forudspecificerede midlertidige analyse af randomiserede kliniske forsøg reducerede signifikant risikoen for symptomatisk COVID-19, og alvorlige bivirkninger var sjældne. " I dette fase 3 randomiserede forsøg med voksne var effekten af de 2 inaktiverede hele virusvacciner i symptomatiske COVID-19-tilfælde henholdsvis 72,8% og 78,1%. 2 vacciner havde sjældne alvorlige bivirkninger med samme hyppighed som alun-kontrolgruppen, og de fleste var ikke relateret til vaccination. En undersøgende analyse viste, at de 2 vacciner inducerede målbare neutraliserende antistoffer, svarende til resultaterne af fase 1/2 -forsøget.
WHO SAGE Working Group offentliggjorde en anmeldelse af Sinopharm/BBIBP COVID-19-vaccinen den 10. maj 2021. GAVIs COVID-19-vaccine indeholder en monitor til hætteglas med vaccine, der fortæller sundhedsarbejdere, om vaccinen er blevet opbevaret korrekt og ikke har været udsat for overophedning. Som følge heraf beskadigede GAVI den 14. maj 2021. Smarte etiketter fremstillet af Zebra Technologies og fremstillet af Temptime Corporation består af en cirkel med en lysere firkant i midten, lavet af et farveløst kemikalie, der uopretteligt udvikler farve over tid . Dette bliver mørkere for at give en visuel indikation af kumulativ varmeeksponering. Når hætteglasset har været udsat for varme ud over dets optimale lagringsområde, bliver firkanten mørkere end cirklen, hvilket indikerer, at vaccinen ikke længere skal bruges.
National Drug BBIBP-CorV COVID-19 vaccinemedicinbiblioteks registreringsnummer: DB15807.